いろいろな塩の違いとは?
home >>> いろいろな「塩」の違いとは? TOP >>> 塩作りの原理
塩作りの原理
海水を濃縮して起こること
前のページ「各成分の味と性質」にあるとおり、海水の様々な成分は、みんな味が違う。そして、海水を濃くしていくと、それらの成分は早くに析出してくるものもあるし、遅くに析出してくるものもある。では実際に海水を濃縮すると、どういうことが起こるかを見てみましょう。下の図は、海水(塩分濃度約3.4%)が天日で濃くなるにつれ、各成分が析出する様子を示したものです。
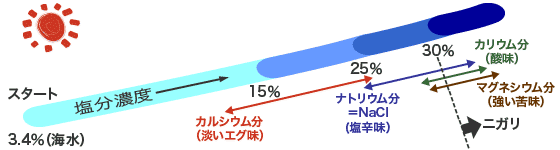
海水が濃くなり、13%ぐらいになると、一番固まりやすい(溶けにくい)カルシウム分(淡いエグ味)だけが最初に析出を始めます。そしてしばらくはカルシウム分だけが析出し続けます。ですから、例えば、20%ぐらいの塩分濃度では、カルシウム分だけが塩(固体)になっており、をはじめ他の成分はまだ母液の中に溶け込んだまま。そして、25%になるとようやくが析出を始め、27〜28%になると、カリウム分・マグネシウム分がと並行して析出し、塩(固体)になっていきます。
このままずっと海水を濃縮していくと、・カリウム分・マグネシウム分がどんどん塩に含まれていくのですが、強い苦味のマグネシウム分があまり多く含まれてしまうと苦過ぎるため、30%あたりで塩を引き上げます。その塩を引き上げた後、残った母液がニガリ(苦汁)です。ニガリは、カルシウム分は全部、も大部分は析出してしまっています。そして残っているカリウム分は元々マグネシウム分より少ないため、主成分はマグネシウム分になります。マグネシウム分は強い苦味の成分。だから、ニガリ(苦汁)は文字通りとても苦いのです。ときどき「海水からニガリをどうやって抜くのですか?」と質問を受けますが、生産現場では「抜く」というより「残す」という感覚です。
これが塩の出来方の原理です。自然の摂理とも言えましょう。天日より温度の高い釜焚きでは多少の違いがありますが、だいたい同じようなことが起こります。大事なのは、海水中の各成分は、その比率を保ちながらみんな一緒に塩(固体)になっていくのではなく、みんな決まった別々のタイミングで塩(固体)になっていくということです。
以上は、水分を飛ばしながら海水を濃縮すると、このように海水の各成分が塩(固体)になっていきますよ、というだけの説明です。析出した各成分がそのまま出来上がる塩に含まれるということではありません。
海水についてにもあるとおり、海水の成分は世界中ほぼ共通。そして、その海水の水分を飛ばしながら濃縮すると、共通した原理によって同じように各成分が析出する。つまり、塩の成分・味の違いは、『この原理をどのように使うか?』によって決まるのです。それをこの次の章から見ていきましょう。