いろいろな塩の違いとは?
home >>> いろいろな「塩」の違いとは? TOP >>> 具体的な塩の違い >>> イオン膜塩
イオン膜塩
イオン膜製法とは?
イオン膜塩
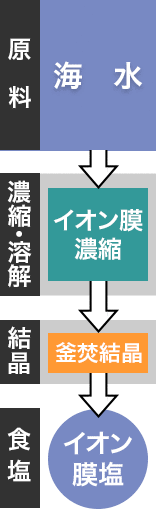
- 原料:海水
- 工程:イオン膜、立釜
「イオン膜塩」と言うと、聞き慣れないかも知れませんが、コンビニやスーパーなどでよく見かける、とてもポピュラーな食塩です。「海水」を原料とし、「イオン膜濃縮」して『濃い海水』を作り、それを「釜焚結晶」させて出来上がった食塩です。
この「イオン膜濃縮」は、天日や釜焚きなどで海水を濃縮する方法とは全く違う原理であるため、先にたびたび引用した「塩作りの原理」は当てはまりません。また、この「イオン膜濃縮」による塩作りは、世界中で行われていますが、天候・気候に影響されずに出来ることから、年間を通してとても安定した生産をすることが可能です。また、この食塩の「釜焚結晶」は立釜(真空蒸発缶)になります。
原料は「海水」だけです。例えば、カンホアの塩の原料も「海水」だけですから同じですが、「イオン膜濃縮」は、様々ある海水中の成分の中から、NaClになるナトリウム(Na+)と塩素(Clー)を選んで濃縮する技術です。ご興味のある方は、下記をご参照ください。
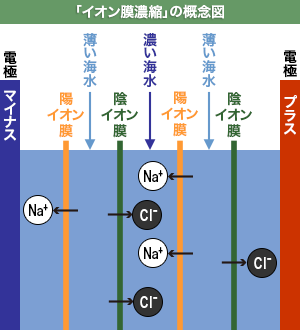 天日や釜焚きで海水の水分を飛ばすと『濃い海水』が出来ますが、この「イオン膜濃縮」では、水分は飛ばしません。海水を「ナトリウム(Na+)と塩素(Clー)を濃くした海水」と「薄い海水」に分けることで、NaClの濃縮液を作ります。
天日や釜焚きで海水の水分を飛ばすと『濃い海水』が出来ますが、この「イオン膜濃縮」では、水分は飛ばしません。海水を「ナトリウム(Na+)と塩素(Clー)を濃くした海水」と「薄い海水」に分けることで、NaClの濃縮液を作ります。
左図は、「イオン膜濃縮」の概略図です。まず、海水に溶け込んでいるNaClは、陽イオンのナトリウム(Na+)と陰イオンの塩素(Clー)に分かれています。
この装置の中は、陽イオンしか通さない陽イオン膜(マイナスに帯電)と陰イオンしか通さない陰イオン膜(プラスに帯電)がひとつおきに並んでいて、海水が入っています。
その両端にプラスとマイナスの電極があり、電気を通します。すると、陽イオンのナトリウム(Na+)はマイナスの電極の方向に、また陰イオンの塩素(Clー)はプラスの電極の方向へ移動します。陽イオンのナトリウム(Na+)は、陽イオン膜を通りますが、陰イオン膜は通りません。反対に、陰イオンの塩素(Clー)は、陰イオン膜を通りますが、陽イオン膜は通りません。
こうして、ナトリウム(Na+)と塩素(Clー)が濃い部屋と薄い部屋がひとつおきにできます。(図では膜は各2つしかありませんが、実際は膜も部屋ももっとたくさんあります) そしてその『ナトリウム(Na+)と塩素(Clー)が濃い部屋』の『濃い海水』を「釜焚結晶(立釜)」させると、NaClの純度が高い食塩が出来上がります。
もちろん海水は、ナトリウム(Na+)と塩素(Clー)だけでなく、マグネシウム(Mg+)・カルシウム分(Ca+)、硫酸基(SO4ー)・臭素(Brー)など様々な成分も含んでいますが、このイオン膜は、ナトリウム(Na+)と塩素(Clー)を選択的に通す性質を持っているため、『濃い塩水』をほとんどナトリウム(Na+)と塩素(Clー)にすることが出来ます。